PreScission Protease是一种大肠杆菌中重组表达的带GST标签的人鼻病毒14型的3C蛋白酶(human rhinovirus (HRV) type 14 3C protease),也称HRV 3C Protease或HRV3C Protease,能在低温条件下(4°C)特异性地识别八肽序列Leu-Glu-Val-Leu-Phe-Gln-Gly-Pro或核心五肽序列Leu-Phe-Gln-Gly-Pro,并在Gln和Gly氨基酸残基之间进行酶切,常用于去除融合蛋白的Glutathione S-transferase (GST)、His或者其它标签的蛋白酶。
建议把GST或His等标签设计在融合蛋白的N端,在GST或His等标签与目的蛋白之间设计加入PreScission Protease 专一性识别与酶切的上述八肽序列,这样在GST或His标签被酶切后,在目的蛋白的N端仅有两个额外的Gly-Pro氨基酸残基,从而最大限度地减少了对其结构和功能的影响。
本PreScission Protease带有GST标签,特别适合用于GST标签蛋白的在柱酶切。在切割GST标签蛋白的时候,切下的GST标签和PreScission Protease可结合于GST纯化柱(GST-tag Purification Resin)上,而目的蛋白在穿透液中,这样洗脱下来的蛋白中就不会含有GST标签和PreScission Protease,从而极大地方便了目的蛋白的纯化。GST标签酶切去除的详细说明可以参考碧云天的P2251/P2253/P2255 BeyoGold™ GST-tag Purification Resin和P2262 GST标签蛋白纯化试剂盒的说明书。
酶活性单位定义:5°C反应16小时,能够切割100μg GST标签蛋白达90%以上所需的酶量定义为一个活性单位。
碧云天PreScission Protease酶活性鉴定结果可参考图1。
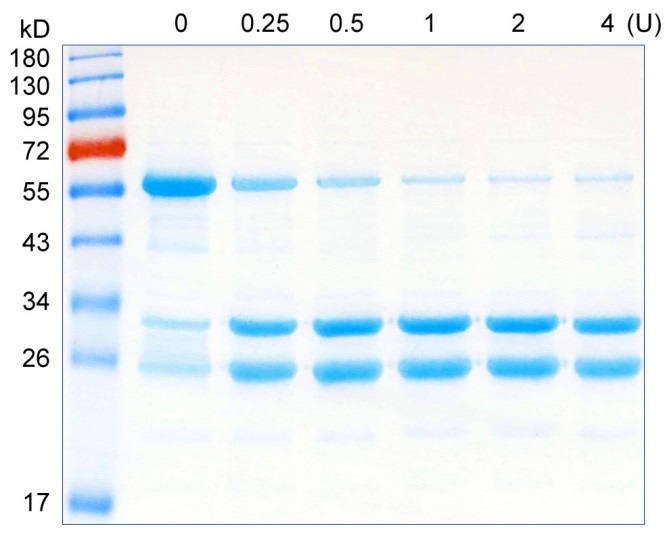
图1. PreScission Protease切割GST标签蛋白的效果图。含有PreScission Protease识别位点的56kD GST标签蛋白与PreScission Protease进行反应,底物的用量为100μg,酶的用量依次为0、0.25、0.5、1、2、4U,5°C在1X PreScission Buffer中反应16小时后取样进行SDS-PAGE电泳和考马斯亮蓝染色。酶切产物大小为约30kD的目的蛋白和约26kD的GST标签。
PreScission Protease分子量大小约46 kDa,纯度≥95%。
PreScission Protease储存液组成为:50mM Tris-HCl,150mM NaCl,10mM EDTA,1mM DTT,50%(v/v) glycerol,pH 8.0。
10X PreScission Buffer组成为:500mM Tris-HCl,1.5M NaCl,10mM EDTA,10mM DTT,pH 7.5。
PreScission Protease的酶切体系中可以兼容1% Triton X-100、Tween-20或NP-40,10mM EDTA和500mM NaCl。
本产品一个包装含有100单位的酶,可用于约10mg带有PreScission Protease识别位点的融合蛋白的切割。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| P2302-1 | PreScission Protease (2U/μl) | 50μl |
| P2302-2 | 10X PreScission Buffer | 1.2ml |
| — | 说明书 | 1份 |
保存条件:
-20℃ 保存。
注意事项:
100mM ZnCl2、4mM AEBSF和100μM Chymostatin会抑制PreScission Protease的酶活性50%以上。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 初始反应条件(适用于绝大多数GST标签蛋白的酶切)
a. 反应温度:4°C。
b. 反应时间:16 h或过夜。
c. 酶量:1:25~1:100(U/μg)。
2. 反应条件的优化
由于不同标签蛋白具有不同的特性,所以在实际使用时,建议对酶和标签蛋白的比例进行适当优化,以下是一个简单的估计酶用量的实验方案。
a. 按照下表设置酶切反应体系:
| 组分 | 体积(μl) |
| H2O | X |
| 10X PreScission Buffer | 10 |
| 标签蛋白(100μg) | Y |
| PreScission Protease (2U/μl) | 0、0.5、1或2 |
| 总体积 | 100 |
注:如果标签蛋白浓度为5μg/μl,那么Y=100/5=20,即须使用20μl 5μg/μl的标签蛋白。
b. 将反应混合物放置于4°C反应16小时或者过夜。
c. 取20μl样品进行SDS-PAGE电泳分析,确定反应所需的合适酶量。在实际操作过程中,如果有必要,还可以在反应的不同时间点取少量样品,后续通过电泳分析来确定优化的反应时间。
3. 柱上酶切含GST标签的融合蛋白(以8mg GST标签蛋白/ml凝胶为例,不同量的GST标签蛋白可以按此比例换算)
a. 在GST标签蛋白结合于纯化柱(1ml)并用洗涤液充分洗涤后,再用10倍柱床体积PreScission Protease的酶切缓冲液平衡柱子。PreScission Protease的酶切缓冲液的组分为50mM Tris-HCl,150mM NaCl,1mM EDTA,1mM DTT,pH7.5。
b. 准备PreScission Protease:约每100μgGST标签蛋白使用2U PreScission Protease (或按照经步骤2优化后的条件)。对于8mg GST标签蛋白需使用160U PreScission Protease,用PreScission酶切缓冲液稀释至与凝胶柱相同的体积,即1ml。
c. 将稀释好的1ml PreScission Protease泵入纯化柱中,4°C保持4-8h(为确保酶切完全,可以4°C酶切过夜)。如果蛋白结合是在离心管中进行的,可将准备好的PreScission Protease直接加入离心管中,4°C在摇床上缓慢摇动4-8小时(为确保酶切完全,可以4°C酶切过夜)。
d. 用1倍柱床体积的PreScission Protease酶切缓冲液洗涤,重复三次,分别收集每次的洗涤液。如果酶切反应是在离心管中进行的,1000g离心2分钟,收集上清,然后加入1ml酶切缓冲液重悬沉淀,离心(1000g×2min)收集上清,接着再加入1ml酶切缓冲液重悬沉淀,离心(1000g×2min)收集上清。洗脱组分中含有切除了GST标签的目的蛋白,而GST标签和带有GST标签的PreScission Protease则仍然结合在凝胶柱上。
4. 洗脱后酶切含GST、His等标签的融合蛋白(以8mg标签蛋白/ml凝胶为例,不同量的GST标签蛋白可以按此比例换算)
a. 使用脱盐柱快速除去洗脱组分中的GSH、咪唑等特殊组分,或用PreScission Protease酶切缓冲液进行透析。
b. 按每100μg标签蛋白加入2U PreScission Protease的比例加入蛋白酶,如果蛋白未定量,可以按照每1ml凝胶加入160U
PreScission Protease (按照每毫升凝胶结合8mg标签蛋白进行预估)的比例进行。4°C孵育4-8h或者过夜。
c. 将酶切后的蛋白样品加入预先用PreScission Protease酶切缓冲液平衡好的BeyoGold™ GST-tag Purification Resin,室温结合20-30分钟。
d. 500g离心5分钟,收集上清,其中含有切除了标签的目的蛋白,PreScission Protease则结合在凝胶沉淀中。如果目的蛋白是GST标签蛋白,那么残留的没有被酶切的GST标签蛋白、PreScission Protease和酶切下来的GST标签则结合在凝胶沉淀中,切除了标签的目的蛋白在溶液中。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| P2251 | BeyoGold™ GST-tag Purification Resin | 10ml |
| P2253 | BeyoGold™ GST-tag Purification Resin | 100ml |
| P2255 | BeyoGold™ GST-tag Purification Resin | 1000ml |
| P2262 | GST标签蛋白纯化试剂盒 | 10ml |
| P2302 | PreScission Protease | 100U |
| P2303 | PreScission Protease | 500U |
| P2307 | TEV Protease | 1000U |
| P2308 | TEV Protease | 10000U |
| D2916 | pET-N-GST-PreScission | 1μg |
| D2933 | pET-Dual-N-GST-PreScission | 1μg |